Atome und Teilchen (1)
Atome bestehen aus noch kleineren Teilchen. Aus experimentellen Daten, die in den vergangenen hundert Jahren gesammelt wurden, konnten Wissenschaftler ihre Modelle (Beschreibungen) von Atomen und deren Teilchen entwickeln und verbessern.
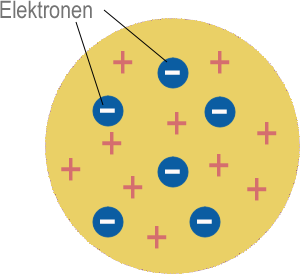
Thomsonsches Atommodell (Plumpudding Modell, dt. Rosinenkuchenmodell)
Das Elektron war das erste atomare Teilchen, das entdeckt wurde. Es wurde von J. J. Thomson 1897 identifiziert. Das Elektron hat eine negative (-) elektrische Ladung, also muss ein Atom mit Elektronen darin auch positive (+) Ladung enthalten, um es elektrisch neutral zu machen. Thomson schlug vor, dass ein Atom eine Hülle von positiver Ladung sein könnte, mit Elektronen, die darin verteilt sind, ähnlich wie Rosinen in einem Kuchen. Dies wurde als "Plumpudding" Modell bekannt.
Rutherfordsches Kern-Hülle Modell
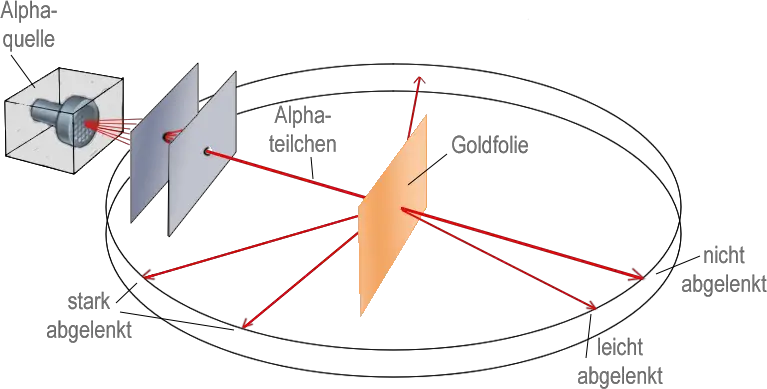
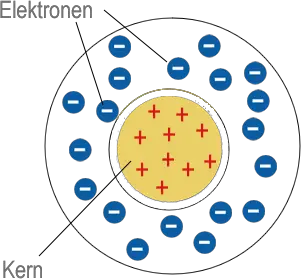
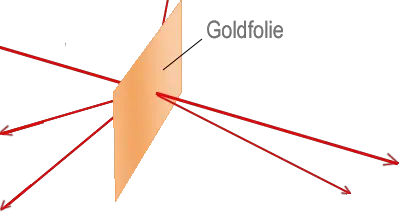
Das Goldfolienexperiment von Geiger und Marsden lieferte Ergebnisse, die mit dem "Plumpudding-Modell" nicht erklärt werden konnten. Eine dünne Goldfolie wurde mit Alphateilchen beschossen, die positiv geladen sind. Die meisten gingen direkt durch die Goldatome hindurch, aber einige wurden durch die elektrische Ladung so stark abgestoßen, dass sie zurückprallten oder in einem großen Winkel abgelenkt wurden. Rutherford schloss daraus, dass ein Atom aus weitgehend leerem Raum bestehen muss, und dass die positive Ladung und der größte Teil seiner Masse in einem winzigen Kern in der Mitte konzentriert sind. In seinem Modell umkreisten die viel leichteren Elektronen den Kern eher wie Planeten um die Sonne.
| Rutherfords Erklärung für das Verhalten der Alphateilchen beim Streuversuch | ||
|---|---|---|
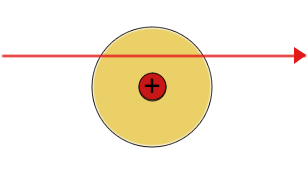
|
|
|
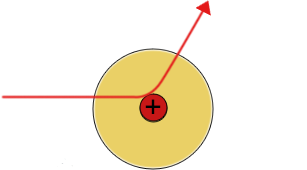
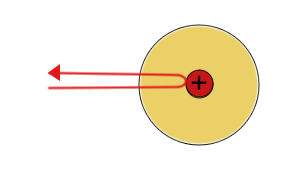
| Die meisten Alpha(+) Teilchen werden nicht abgelenkt | Einige Alpha-Teilchen werden leicht abgelenkt | Einige Alpha-Teilchen werden vom Atomkern abgestoßen und prallen zurück |
Die Entdeckung von Teilchen im Atomkern
Rutherfords Modell sagte nichts über das Innere des Atomkerns aus. Im Jahr 1919 bombardierte er jedoch Stickstoffgas mit schnellen Alphateilchen und fand heraus, dass positiv geladene Teilchen herausgeschlagen wurden. Dies waren Protonen. Im Jahr 1932 entdeckte James Chadwick, dass der Kern auch ungeladene Teilchen mit einer ähnlichen Masse wie Protonen enthielt. Diese nannte er Neutronen.
Das Problem der Spektrallinien
Wissenswertes über Licht
Licht ist eine Form von elektromagnetischer Strahlung (elektromagnetische Welle). Die Farbe des Lichts hängt von der Wellenlänge ab.
Licht wird von Atomen ausgesandt. Das Spektrum des weißen Lichts ist ein kontinuierlicher Farbbereich von Rot (die längste Wellenlänge) bis Violett (die kürzeste Wellenlänge). Nicht alle Spektren sehen jedoch so aus. Wenn zum Beispiel eine elektrische Entladung in Wasserstoff stattfindet, emittiert das glühende Gas nur bestimmte Wellenlängen, so dass das Spektrum aus einzelnen Linien besteht, wie unten gezeigt. So wie es war, konnte Rutherfords Modell nicht erklären, warum solche Spektren auftraten. Um dieses Problem zu lösen, musste das Modell verbessert werden.

Bohrsches Atommodell
Im Jahr 1913 modifizierte Niels Bohr Herrn Rutherfords Modell, indem er die von Max Planck im Jahr 1900 entwickelte Quantentheorie verwendete. Nach dieser Theorie kann Energie nicht in immer kleinere Mengen aufgeteilt werden. Sie wird nur in winzigen "Paketen" emittiert (oder absorbiert), die jeweils als Quanten bezeichnet werden. Herr Bohr wies darauf hin, dass Elektronen in höheren Umlaufbahnen mehr Energie haben als solche in niedrigeren Umlaufbahnen. Wenn also nur Quantenenergieänderungen möglich sind, sind nur bestimmte Elektronenbahnen erlaubt. Dieses modifizierte Modell ist als Bohrsches Atommodell oder Rutherford-Bohr-Modell bekannt.
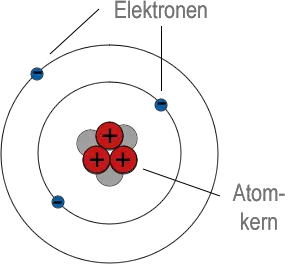
Anhand des Modells konnte Herr Bohr erklären, warum Atome nur Licht bestimmter Wellenlänge emittieren (siehe nächstes Kapitel). Er hat sogar die Positionen der Linien im Wasserstoffspektrum vorhergesagt. Seine Berechnungen funktionierten jedoch nicht für Substanzen mit einer komplizierteren Elektronenstruktur. Um dieses Problem zu lösen, haben Wissenschaftler ein Wellenmechanikmodell entwickelt, in dem zulässige Bahnen durch erlaubte Energieniveaus ersetzt werden. Dies ist jedoch ein vollkommen mathematischer Ansatz, und somit wird das Rutherford-Bohr-Modell immer noch verwendet, um Atome bildlich darzustellen.
Fragen
Richtig ist:
Richtig ist:
- ... die meisten Alphateilchen direkt durch die Folie gehen?
- ... einige Alphateilchen in einem großen Winkel abgelenkt werden?
Richtig ist:
Richtig ist: