Franck-Hertz-Versuch
Als Franck-Hertz-Versuch wird das vorletzte Glied einer dreijährigen Serie von Experimenten bezeichnet, mit denen James Franck und Gustav Hertz untersuchten, wie viel Energie von einem Elektron bei einem Stoß mit einem Atom auf dieses übertragen wird. Der Versuch wurde 1914 durchgeführt und gilt, obwohl die beiden Experimentatoren zunächst eine andere Interpretation vertraten, als erster direkter Beleg für diskrete Energieniveaus in Atomen, wie sie 1913 von Niels Bohr in den Bohrschen Postulaten theoretisch gefordert worden waren. Das Experiment stützte das Bohrsche Atommodell, das bis zur Entwicklung der Quantenmechanik im Jahr 1925 erheblich zur Fortentwicklung der Quantenphysik beitrug. Franck und Hertz erhielten für dieses Experiment im Jahr 1925 den Nobelpreis für Physik.
In dem Experiment wird gemessen, wie viel Energie den Elektronen verbleibt, nachdem sie ein Gas aus Quecksilberatomen durchquert haben, in dem sie durch ein elektrisches Feld beschleunigt werden. Die Messungen zeigen, dass die Elektronen nach Durchlaufen einer Beschleunigungsspannung von weniger als 4,9 V mit den Atomen nur elastisch zusammenstoßen und dabei praktisch keine Energie übertragen. Oberhalb dieser Schwelle geben sie beim Stoß 4,9 eV Energie an das Atom ab. Im letzten Versuch ihrer Versuchsreihe wiesen Franck und Hertz dann nach, dass die Atome, die diese Energie aufgenommen hatten, Licht aussenden, dessen Photonen gerade die Energie 4,9 eV besitzen. Damit wurde auch das zweite Bohrsche Postulat im Experiment bestätigt. Die Versuche zeigen, dass in Atomen Energieaufnahme und -abgabe nur in Form diskreter Energiepakete (Quanten) erfolgt.
Der Franck-Hertz-Versuch gehört zu den eindrucksvollsten Belegen der Quantenphysik und ist gleichzeitig relativ einfach aufgebaut. Er ist deshalb ein beliebter Demonstrations- und Praktikumsversuch in der Physikausbildung.
Einordnung
Zu Beginn des 20. Jahrhunderts war durch spektroskopische Untersuchungen (z. B. bei Gasen die Emissions- und Absorptionslinien, speziell die bekannten Fraunhoferlinien und das Phänomen der Resonanzfluoreszenz) und bei Metalloberflächen durch den Photoeffekt bekannt, dass der Energieaustausch zwischen Licht und Atomen oder auch einzelnen Elektronen nur in bestimmten Energiepaketen erfolgt, den Lichtquanten.
1913 hatte Niels Bohr das nach ihm benannte Atommodell aus der Vorstellung heraus entwickelt, dass es die Zustände zu bestimmten festgelegten Energien, die Energieniveaus, auch im Atom gebe. Mit einer zusätzlichen Annahme, welche Zustände ein Elektron im Atom einnehmen kann, konnte das schon länger bekannte Linienspektrum des Wasserstoffs erklärt werden. Atome geben demnach Energie ab oder nehmen welche auf, indem sie von einem der möglichen Zustände zu einem anderen wechseln und dabei nach der Quantenphysik ein Lichtquant emittieren oder absorbieren, dessen Energieinhalt durch die Energiedifferenz der beiden Zustände gegeben ist. Durch die bohrsche Frequenzbedingung, die der von Albert Einstein 1905 aufgestellten Formel für die Lichtquanten entspricht, wird die Wellenlänge des Lichtquants durch die Energieänderung $ \Delta E $ des Atoms gegeben:
- $ \Delta E=|E_{a}-E_{e}|=h\nu ={\frac {hc}{\lambda }} $.
Darin ist
- $ E_{a} $ die Energie des Anfangszustandes,
- $ E_{e} $ die Energie des Endzustandes,
- $ c $ die Lichtgeschwindigkeit,
- $ \nu $ die Frequenz der Spektrallinie und
- $ h $ das Plancksche Wirkungsquantum.
Indem das Atom die Energie nicht von einem Lichtquant, sondern durch einen unelastischen Elektronenstoß erhält, bestätigte der Franck-Hertz-Versuch die diskreten Energieniveaus des Atoms.
Franck und Hertz hatten ihre Versuche allerdings nicht durchgeführt, um das Bohrsche Atommodell zu überprüfen, denn dieses war ihnen damals erst flüchtig bekannt. Sie wollten mit ihrer Apparatur Ionisierungsenergien einatomiger Gase messen, weil Ionisierung nach damals verbreiteter Lehre die einzige Form ist, in der Atome Energie aufnehmen können (abgesehen von kinetischer Energie des ganzen Atoms), und weil die damals allgemein anerkannte Theorie für elektrische Entladungen von J.S. Townsend bei den einatomigen Gasen versagte.[1] Die Entstehung der Lichtquanten, deren Energie genau mit dem Energieverlust der stoßenden Elektronen übereinstimmte, sahen sie als Folge der Rekombination des Quecksilberions mit einem Elektron, denn hierbei wird genau die Ionisierungsenergie wieder frei. Dies war bis zur Vorstellung der Bohrschen Postulate auch die allgemein akzeptierte Deutung. Franck und Hertz bekräftigten ihren Standpunkt, dass 4,9 eV die Ionisierungsenergie sei, auch noch 1916, nachdem das Bohrsche Atommodell sich schon weitgehend durchgesetzt hatte und ihr Experiment allgemein als direkte Bestätigung der Bohrschen Postulate angesehen wurde. Der überzeugende experimentelle Nachweis, dass Quecksilber bei 4,9 eV Energiezufuhr nicht ionisiert wird, sondern erst bei 11,4 eV, erfolgte tatsächlich erst 1917 durch Davis und Goucher[2], und erst danach stimmten Franck und Hertz der Interpretation (wie in der Einleitung dargestellt) zu, die sich nun endgültig als die richtige herausgestellt hatte.
Franck-Hertz-Versuch
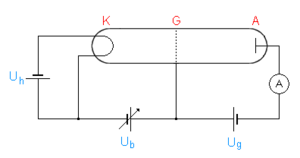
Versuchsanordnung
In einem Glaskolben befindet sich ein Gas (meist Quecksilberdampf, aber auch Neon ist üblich) mit niedrigem Druck, typischerweise im Bereich von 10 bis 20 mbar. An einem Ende befindet sich eine Glühkathode K, die durch die Stromquelle Uh beheizt wird. Das Gitter G in cm-Abstand liegt durch die regelbare positive Spannung Ub (im Bereich einiger V) auf positivem Potential gegenüber der Kathode. Die Auffangelektrode A, an der der Strom gemessen wird, befindet sich direkt hinter dem Gitter und liegt gegenüber diesem auf leicht negativem Potential Ug von etwa 1 V.
Sinn dieser Anordnung ist, Elektronen zwischen K und G zu beschleunigen und mit den Quecksilberatomen zusammenstoßen zu lassen. Das schwache Gegenfeld zwischen G und A schließt dann alle Elektronen von der Strommessung aus, die beim Durchtritt durch G nicht eine gewisse Mindestenergie haben (Gegenfeldmethode).
Die von der Kathode emittierten Elektronen werden beschleunigt und erreichen unmittelbar vor dem Gitter ihre höchste Geschwindigkeit. Die Elektronen, die auf dem Gitter landen, werden durch die Stromquelle Ub wieder zur Kathode zurücktransportiert. Die anderen passieren das Gitter und werden von dem schwachen elektrischen Feld zwischen Gitter und Auffangelektrode A abgebremst. Elektronen geringer Energie können das Gegenfeld nicht überwinden und landen schließlich auch auf dem Gitter. Nur die Elektronen mit genügender Energie treffen auf A und werden auf dem Rückweg mit Hilfe eines empfindlichen Amperemeters gemessen.
Durchführung und Beobachtung
Erhöht man von Ub=0 ausgehend die Beschleunigungsspannung über den Wert von Ug, beginnen die gemessenen Stromwerte zunächst anzuwachsen (Bereich (1) in der Abb.). Ab einem bestimmten (von der Gasfüllung abhängigen) Spannungswert fällt der Strom ab (2), erreicht einen Minimalwert und steigt dann wieder an (3). Etwa bei dem doppelten Wert der Spannung, bei dem der Strom zum ersten Mal sinkt, fällt er erneut ab (4) und steigt danach wiederum an. Dies wiederholt sich näherungsweise periodisch, dabei steigt die Stromstärke jedes Mal auf einen höheren Wert. (Im Gegensatz zu vielen vereinfachten Darstellungen sind die Abstände zwischen den Maxima bzw. Minima nicht ganz konstant (siehe unten).[3]
Beim Versuch mit Neon sieht man beim Erreichen des ersten Minimums eine leuchtende Schicht vor dem Gitter, die mit weiter steigender Spannung Richtung Kathode wandert. Bei jedem neuen Minimum entsteht eine weitere leuchtende Schicht. Mit Quecksilber kann man dies nicht beobachten, weil die entstehende Strahlung im UV-Bereich liegt.
Der gesamte Strom durch die Röhre, also der Kathodenstrom oder die Summe aus Gitter- und Auffängerstrom, zeigt keine solchen periodischen Änderungen, sondern steigt mit steigender Spannung proportional zu Ub3/2 an (Schottky-Gleichung), wie in einer Röhrendiode. Anders als in Vakuumröhren sättigt der Strom aber nicht bei hoher Spannung, sondern steigt ab einer bestimmten Zündspannung (bei Quecksilber hier etwa 40 V) wegen der einsetzenden Gasentladung schlagartig stark an. Um eine Zerstörung der Röhre zu vermeiden, wird der Strom deshalb im Versuchsaufbau durch einen passenden Widerstand in Reihe mit der Kathode begrenzt.
Erklärung
Bei geringen Spannungen steigt der Strom mit der Spannung an, weil das beschleunigende Feld stärker wird und (wie in jeder Vakuumröhre) mehr Elektronen aus der Raumladungszone um die Kathode absaugen kann. Der drastische Abfall der Stromstärke, wenn die Spannung einen Schwellwert überschreitet, zeigt, dass viele Elektronen auf dem Weg durch das Gas Energie verloren haben, so dass sie wegen des Gegenfelds nicht mehr zum Auffänger durchkommen. Das wird dadurch erklärt, dass die Elektronen, sobald sie eine bestimmte kinetische Energie (bei Quecksilber ca. 4,9 eV, entspricht Übergang vom $ 6^{1}S_{0} $- zum $ 6^{3}P_{1} $-Niveau) erreichen, beim Stoß mit einem Atom diese Energie abgeben können, also unelastisch stoßen. Bei geringerer Energie kann das Atom (als Ganzes) nur elastische Stöße mit dem Elektron machen, bei denen wegen des großen Massenunterschieds praktisch keine Energie übertragen wird. Bei einem unelastischen Stoß wird das getroffene Atom angeregt, d. h., die übertragene Energie erscheint nicht als dessen Schwerpunktsenergie. Im Bohrschen Atommodell wird die Energie auf ein einzelnes Hüllenelektron übertragen, indem es auf ein höheres Energieniveau gehoben wird. Da dieser Zustand instabil ist, fällt das Elektron unter Emission eines Lichtquants kurze Zeit später (Größenordnung $ 10^{-8}{\text{s}} $) zurück in den früheren Zustand.
Wenn das Elektron vor dem inelastischen Stoß nur knapp über 4,9 eV kinetische Energie besitzt, hat es nachher nicht mehr genügend Energie, um das abbremsende Gegenfeld zu überwinden. Im Minimum sinkt der gemessene Strom jedoch nicht bis auf Null, denn nur ein Teil der Elektronen stößt mit den Atomen unelastisch zusammen. Es gibt immer auch Elektronen, die zwar (kurz vor dem Gitter) die notwendige Energie erreichen, dann allerdings wegen des kurzen Wegs bis zum Gitter keinen Stoßpartner mehr finden. Außerdem kann die von den angeregten Atomen emittierte UV-Strahlung an verschiedenen Stellen der Röhre durch Photoeffekt Elektronen freisetzen, die von der Auffängerelektrode angezogen werden und zum gemessenen Strom beitragen. Franck und Hertz jedoch hatten in ihrer ursprünglichen Interpretation irrtümlich angenommen, bei 4,9 eV werde das Quecksilberatom ionisiert und dieser Minimalwert des Stroms beruhe auf den (positiven) Ionen, die nun zur Kathode wandern. Die von Bohr eingeführte Vorstellung von angeregten Zuständen neutraler Atome war ihnen noch fremd.
Beim weiteren Erhöhen der Beschleunigungsspannung verlagert sich die Zone, wo die Elektronen erstmals die nötige kinetische Energie gewonnen haben, näher zur Kathode. Daher werden die Elektronen nach ihrem Energieverlust wieder ein Stück weit beschleunigt, so dass die Zahl der Elektronen, die die abbremsende Spannung überwinden, wieder größer wird (3). Das gilt, bis die beschleunigende Spannung so groß ist, dass die Elektronen nach dem ersten unelastischen Stoß wieder 4,9 eV aufnehmen und ein zweites Mal inelastisch stoßen können (4). Dann gibt es zwei Zonen angeregter Quecksilberatome, eine auf halbem Weg zum Gitter und eine knapp davor.
Das von den Quecksilberatomen emittierte Licht (der Quantenenergie 4,9 eV) ist mit einer Wellenlänge von ca. 253 nm allerdings im ultravioletten Bereich und damit nicht sichtbar. Jedoch liegen bei 8 eV weitere Niveaus, die nach der Anregung zunächst in das 4,9 eV-Niveau übergehen und dabei ein sichtbares grünes Lichtquant abgeben. Die getrennten leuchtenden Zonen sind mit einer Neon-Füllung gut zu sehen, wenn die Beschleunigungsspannung mehrfach dafür ausreicht, ein Elektron vom vollbesetzten 2p-Niveau in eins der höheren 3p-Niveaus zwischen 18,4 eV und 19,0 eV zu heben. Denn das so angeregte Ne-Atom verliert seine Anregungsenergie zunächst in einem kleinen Schritt zum 3s-Niveau, das ca. 2,5 eV tiefer liegt führt, weshalb sichtbares orange-gelbes Licht entsteht.
Eine genauere Interpretation des Versuchs, die erst am Ende des 20. Jahrhunderts publiziert wurde, berücksichtigt Raumladungseffekte und weiter die Tatsache, dass die Elektronen nicht einen gerichteten Strahl bilden, sondern wegen der zahlreichen elastischen Stöße in alle Richtungen (auch zurück) abgelenkt werden. Für eine vollständige Erklärung müssen auch verschiedenen Niveaus mit ihren unterschiedlichen Anregungswahrscheinlichkeiten berücksichtigt werden. Dies führt beispielsweise dazu, dass weder bei Neon noch bei Quecksilber das niedrigste Anregungsniveau beobachtet wird, sondern ein höheres.[4] [5]
Erweiterungen des Versuchs
Verbesserte Auflösung mit elektrischer „Lupe“
In der einfachen Schaltung des vorhergehenden Kapitels fallen Beschleunigungs- und Reaktionsstrecke der Elektronen zusammen. Durch die Einführung eines zweiten Gitters gelingt es, beide Bereiche zu trennen und mit höherer Energieauflösung auch höhere Energiestufen nachzuweisen.
Dazu wählt man den Abstand zwischen der Kathode und dem Gitter 1 sehr klein, so dass die Elektronen kaum unelastische Stöße mit Gasatomen ausführen können, während sie durch UG1 (etwa 10 V) fast auf die für höhere Niveaus notwendige Energie beschleunigt werden. Zwischen Gitter 1 und Gitter 2 werden sie auf viel größerer Distanz durch eine erheblich geringere Spannung ΔU (der Größenordnung 0,1 V) nachbeschleunigt, wodurch sich ihre Geschwindigkeit nur allmählich steigert. Wie in der ursprünglichen Apparatur (oben), werden unelastische Stöße der Elektronen dadurch nachgewiesen, dass diese die anschließende Gegenspannung zwischen Gitter 2 und der Platte A nicht überwinden können. Die Energieschwelle zum inelastischen Stoß ist damit viel präziser zu beobachten.
Andere Gasfüllungen
Um die Verwendung des giftigen Quecksilbers zu vermeiden und aus didaktischen Gründen wird der Versuch insbesondere in Schulpraktika mit dem Gas Neon durchgeführt. Hier sind die Anregungsenergien höher, sie liegen zwischen 18,4 eV und 19,0 eV – Lichtemission dieser Energie wäre nicht im sichtbaren Bereich. Die Abregung der angeregten Neon-Atome geschieht jedoch auch über Zwischenzustände mit Energien im Bereich zwischen 16,6 eV und 16,9 eV. Daher entstehen auch Photonen im Energiebereich von 2 eV, was zu rot-oranger Lichtemission führt.[6] Entspricht die Spannung einem Vielfachen der Anregungsspannung, so ist in der Röhre eine entsprechende Anzahl nebeneinander liegender leuchtender Bereiche sichtbar.
Weblinks
- LP – Der Franck-Hertz-Versuch auf den Seiten der Universität Göttingen (inkl. Skizzen, Fotos, Videos und Literaturhinweisen)
- Animation auf Schülerniveau (LEIFI)
- Simulation der Elektronenbewegung
Einzelnachweise
- ↑ J. Franck und G. Hertz: Über Zusammenstöße zwischen Elektronen und Molekülen des Quecksilberdampfes und die Ionisierungsspannung desselben. In: Verh. Dtsch. Phys. Ges. Band 16, 1914, S. 457–467, doi:10.1002/phbl.19670230702. (Auszüge online auf LEIFI-Physik)
- ↑ Bergen Davis und F. S. Goucher: Ionization and Excitation of Radiation by Electron Impact in Mercury Vapor and Hydrogen, In: Phys. Rev. Bd. 10 (1917), S. 101–115
- ↑ G. Rapior, K. Sengstock, V. Baev: New features of the Franck-Hertz experiment. In: Amer. J. Phys. Nr. 74, 2006, S. 423–428, doi:10.1119/1.2174033 (uni-jena.de [PDF; abgerufen am 30. Oktober 2020]).
- ↑ R. E. Robson, B. Li und R.D. White: Spatially periodic structures in electron swarms and the Franck-Hertz experiment. In: J. Phys. B: At. Mol. Opt. Phys. Nr. 33, 2000, S. 507, doi:10.1088/0953-4075/33/3/318.
- ↑ R.E. Robson, M. Hildebrandt und R.D. White: Ein Grundstein der Atomphysik. In: Physik Journal. Nr. 3, 2014, S. 43 (pro-physik.de [PDF; abgerufen am 30. Oktober 2020]).
- ↑ Frank-Hertz-Versuch. (PDF; 171 kB) Physikalisches Institut Tübingen, abgerufen am 30. Oktober 2020 (Termschema von Neon die Abbildung FH.2 in einer Versuchs-Anleitungen des Physikalischen Praktikum I+II).